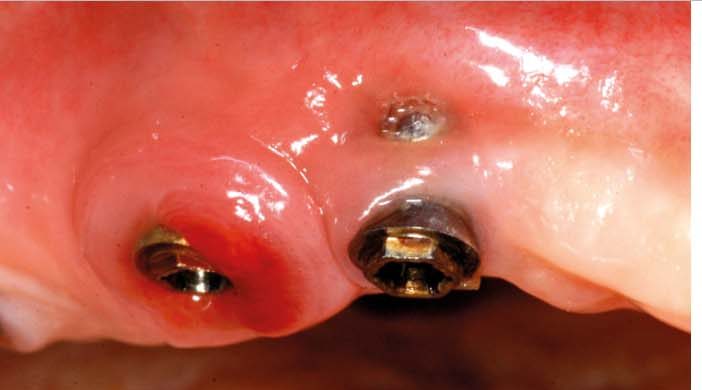
Хирургическое лечение периимплантита направлено на устранение периимплантитных карманов и улучшение доступа для домашней гигиены полости рта. В данном исследовании мы наблюдаем клинические эффекты имплантации в сочетании с хирургическим лечением, как резекционным, так и регенеративным, на выборке из 15 пациентов, страдающих данной патологией.
Паоло Моранди
Франческо Аццола
Николо Кавалли
Бруно Барбаро
Клотильда Остони
Лука Франсетти
Миланский университет, Факультет биомедицинских, хирургических и стоматологических наук, стоматологическая клиника, директор: Проф. Лука ФрансеттиIRCCS Istituto Ortopedico Galeazzi, Милан
Объем работ.Наблюдение за клиническим эффектом имплантопластики при различных хирургических подходах, таких как резекционная и регенеративная хирургия.
Материалы и методы.15 пациентов с 34 имплантатами, страдающих периимплантитом, были обследованы в течение 30-месячного периода. За 6-8 недель до хирургического лечения всем пациентам проводилась нехирургическая терапия. Имплантопластика сочеталась с резекционным или регенеративным хирургическим подходом в зависимости от типа дефекта. Все пациенты прошли повторную оценку через 9 месяцев после операции.
Результаты.За исключением трех зарегистрированных неудач, через 9 месяцев после операции все имплантаты не имели признаков периимплантатного воспаления, средняя глубина зондирования составила 3, 05 ± 0, 89 мм при среднем снижении на 2, 08 ± 1, 89 мм. Только 3, 8% участков имели глубину зондирования ≥ 5 мм.
Выводы.Имплантопластика в сочетании с хирургическим лечением периимплантита улучшила все клинические параметры и может рассматриваться как обоснованный вариант лечения.
Периимплантит — это бляшковидное заболевание, характеризующееся воспалением периимплантатных тканей и резорбцией кости. Как и в случае с пародонтитом, были предложены различные терапевтические подходы, включая нехирургическое лечение, лоскуты доступа, резекционную и регенеративную хирургию, связанные с различными методами обеззараживания поверхности имплантата, такими как аэроабразивные системы, физраствор, лазер, кюретки, ультразвук и другие. Несмотря на все это, в настоящее время не существует единогласно принятых протоколов лечения периимплантита 1.
Как известно из международной литературы (Mellado-Valero et al.2), одно лишь нехирургическое лечение, хотя и позволяет уменьшить воспаление тканей, недостаточно для устранения периимплантита. Поэтому часто в плане лечения необходимо использовать хирургический подход, направленный на восстановление правильных анатомических условий для адекватного контроля зубного налета и предотвращения риска повторного инфицирования.
Периимплантатный дефект может характеризоваться горизонтальной потерей кости (надкостный дефект) или угловой потерей кости (инфракостный дефект); иногда он является результатом комбинации этих двух факторов. В нескольких клинических исследованиях сообщается о положительном эффекте после модификации поверхности имплантата, обычно называемой имплантопластикой, либо в сочетании с резекционным подходом, либо в сочетании резекционного 3, 4 и регенеративного 5, 6 подходов.
Имплантопластика, с помощью вращающихся инструментов, заключается в удалении витков имплантата до получения полированной поверхности; основная цель — удалить самый поверхностный слой титана, загрязненный бактериями, создавая новую нетронутую поверхность, во-вторых, уменьшить шероховатость имплантата, чтобы сделать поверхность менее привлекательной для зубного налета. Цель данной работы — оценить эффективность имплантопластики в сочетании с хирургическим лечением, как с резекционным, так и с регенеративным подходом, на выборке пациентов, страдающих периимплантитом.
Материалы и методы
В исследование были включены 15 пациентов в возрасте от 49 до 80 лет, частично или полностью беззубых и не имеющих абсолютных или относительных противопоказаний к операции; 7 пациентов из отобранных были курильщиками (с дефектами класса I (инфрабони) и II (супрабони) по классификации Schwarz et al.7 . Критерии включения и исключения обобщены в Таблице 1.
Перед хирургическим этапом пациенты были проинструктированы и мотивированы к домашней гигиене полости рта, было проведено нехирургическое лечение периимплантита с использованием тефлоновых кюреток, ультразвукового наконечника с пластиковым покрытием и одновременным орошением 0, 2% хлоргексидином для уменьшения загрязнения внутри дефекта и воспаления тканей. Повторная оценка после нехирургического лечения проводилась через 6-8 недель.
Подготовка к хирургическому лечению остаточных дефектов состояла из полосканий 0, 2% хлоргексидином каждые 12 часов, начиная за три дня до операции, и 875 мг амоксициллина плюс 125 мг клавулановой кислоты каждые 12 часов, начиная с вечера предыдущего дня; субъектам с аллергией на пенициллин назначалось 500 мг кларитромицина каждые 12 часов.
У 8 пациентов были обнаружены периимплантатные дефекты с надкостничным компонентом (класс II), при которых был применен резекционный хирургический подход, а у 6 пациентов были выявлены дефекты с инфракостничным компонентом (класс I), которые лечились с помощью регенеративного подхода; у одного пациента был зарегистрирован дефект класса II, а у другого — дефект класса I, поэтому были использованы оба подхода.
Хирургическая процедура включала: плексическую анестезию артикаина гидрохлоридом 4% и адреналином (1:100000), подготовка мукопериостального лоскута с вертикальными разделительными разрезами, где необходимо, для уменьшения натяжения лоскута, дегрануляция периимплантного дефекта с использованиемтефлоновых кюретоки ультразвукового наконечника, деконтаминация дефекта путем промывания 0, 2% хлоргексидином в чередовании с промыванием физраствором и имплантация в супракрестальную часть имплантата.
 D
D
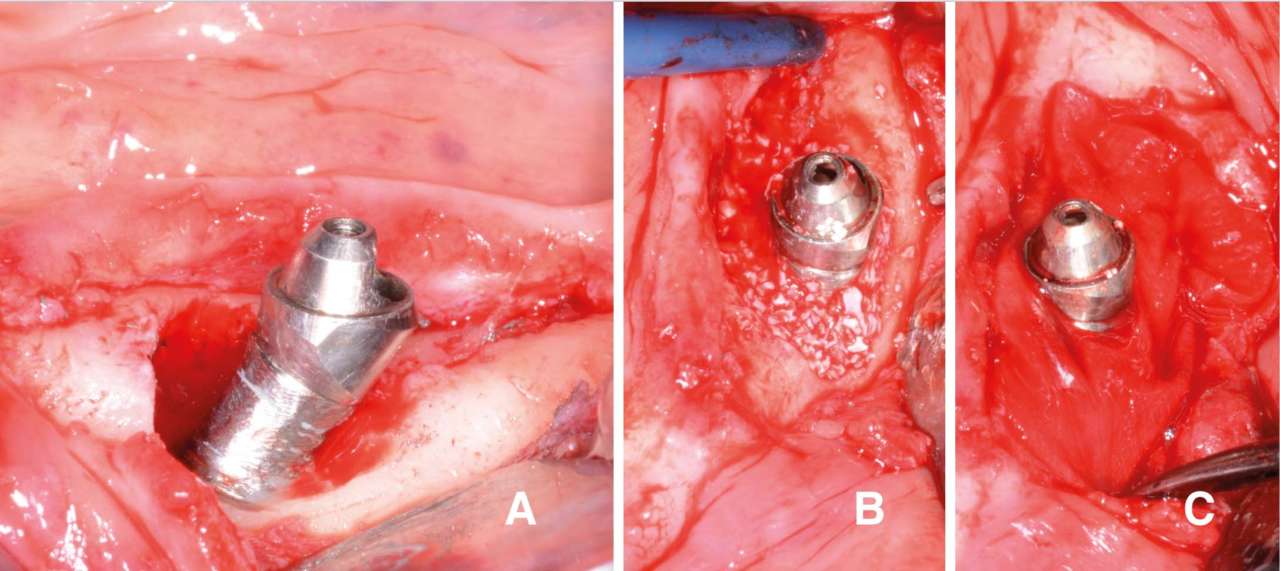
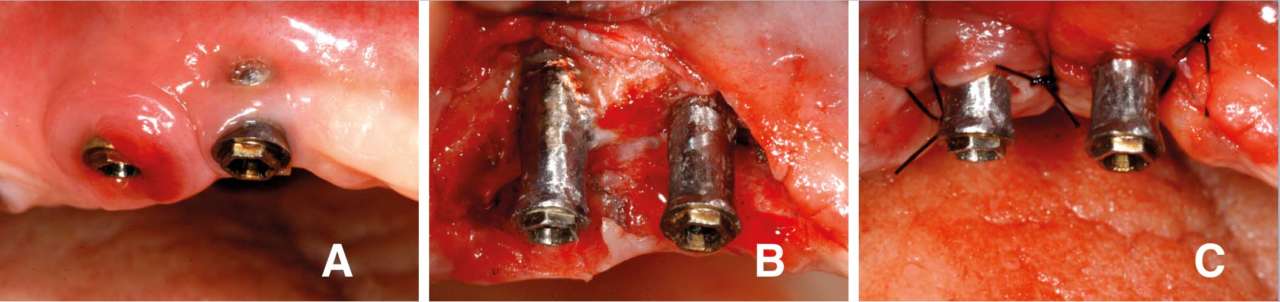
Рис. 1 — Клинический случай с применением регенеративного подхода.
A) имплантопластика; B) заполнение дефекта депротеинизированной бычьей костью;
C) установка мембраны;
D) заживление через 18 месяцев
В группе пациентов с дефектами класса I (рис. 1) инфракостный дефект заполняли гетерологичным костным заменителем на основе депротеинизированной бычьей кости (Bio-Oss®, Geistlich, Wolhusen, Швейцария), размещение рассасывающейся свиной коллагеновой мембраны (Bio-Gide®, Geistlich, Wolhusen, Швейцария) и выполнение вестибулярных периостальных разрезов для высвобождения лоскута и обеспечения закрытия первого намерения и стабильности раны. В группе пациентов с дефектами II класса (рис. 2, 8) после имплантопластики проводилась остеопластика с использованием прямого наконечника и бора с розеткой (30 000 об/мин) для восстановления положительной анатомии кости, истончение нёбного лоскута и репозиция апикального лоскута с использованием монофиламентного нейлонового шва (Ethilon™ 4-0, Ethicon®, Somerville, New Jersey, USA).
Процедура имплантации проводилась с помощью оптических увеличителей (Eyemag Pro S, Zeiss, Oberk ochen, Германия), последовательно использовались: алмазные боры с уменьшающимся размером зерна, установленные на угловой наконечник с красным кольцом (40.000 об/мин) (K omet, Gerb. Brasseler GmbH, Lemgo, Германия), белый камень арканзасского типа и зеленый камень, установленный на угловой наконечник с синим кольцом (40 000 об/мин) и, наконец, красный и зеленый полиры (Brownie, Greenie) (Shofu Inc, Киото, Япония).
Эта процедура проводилась под обильным орошением физраствором для предотвращения перегрева тела имплантата и для облегчения удаления остатков износа имплантата.
По окончании операции пациенты были выписаны с противовоспалительной терапией (напроксен натрия 550 мг, одна таблетка на полный желудок каждые 12 часов в течение 3 дней), полосканиями хлоргексидином 0, 2% дважды в день, гигиеной полости рта и послеоперационными инструкциями. Через 7 дней после операции проводилась проверка заживления, эндоральная рентгенография с центрирующим устройством Ринна и снятие швов.
 D
D
Рис. 2 — Клинический случай с резекционным подходом.
A) предоперационная ситуация;
B) имплантопластика; C) шов; D) двухлетнее заживление
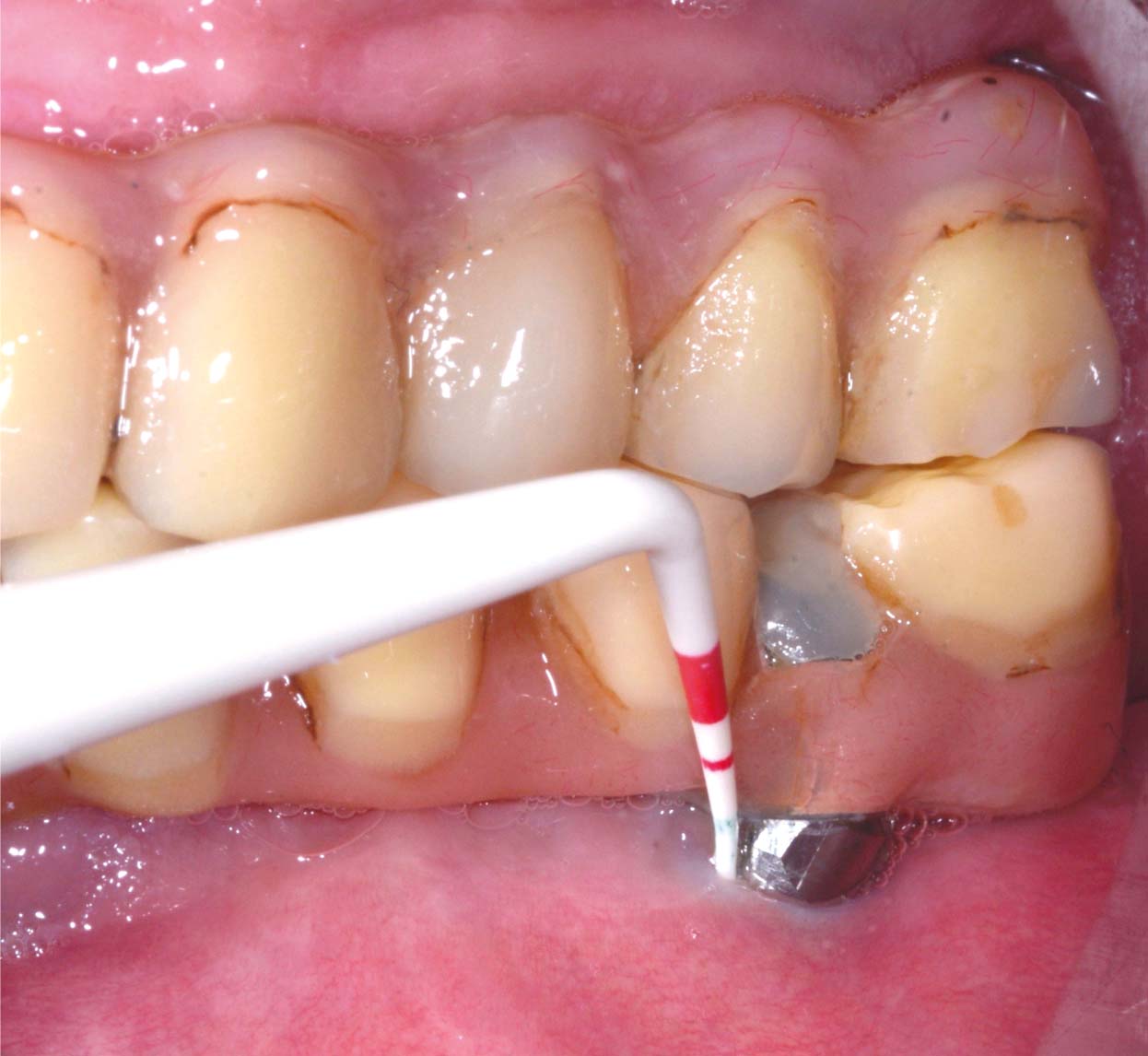
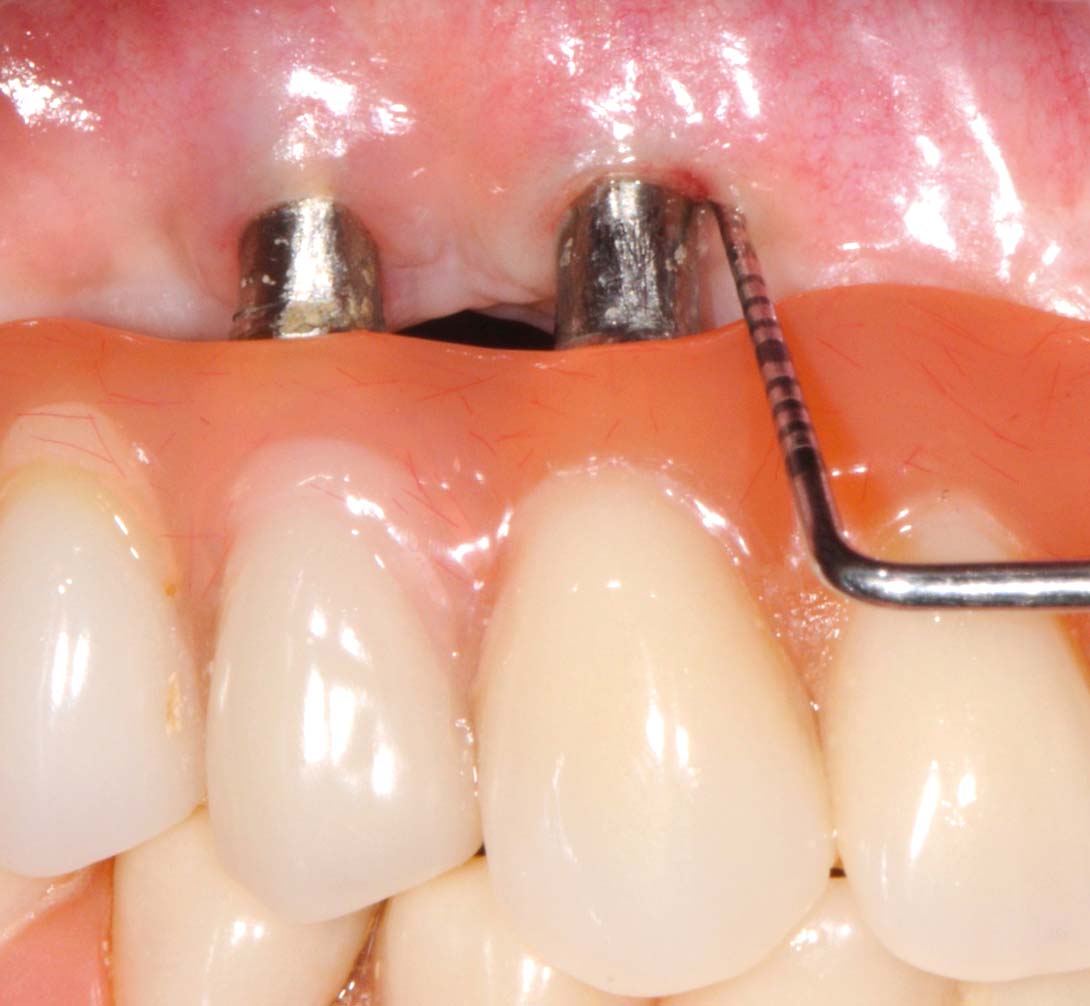
Средний срок наблюдениясоставил 17 ± 8 месяцев: все пациенты проходили последовательное наблюдение минимум до девяти месяцев после операции. Из 15 пациентов и 34 исследованных имплантатов 11 (73, 3%, всего имплантатов 27 или 79, 4%) были повторно обследованы в течение одного года, а 7 (46, 7%, всего имплантатов 23 или 67, 6%) — в течение двух лет. Протокол включал контрольные визиты через один, три, шесть, девять и двенадцать месяцев в первый год после операции и каждые шесть месяцев в дальнейшем; через шесть месяцев регистрировались глубина зондирования (ГЗ), кровотечение при зондировании (КЗ) и уровень кости с помощью контрольной эндоральной рентгенограммы с центрирующим устройством Rinn. Опросы, фотографии и эндоральные рентгенограммы затем повторялись при каждом последующем наблюдении.
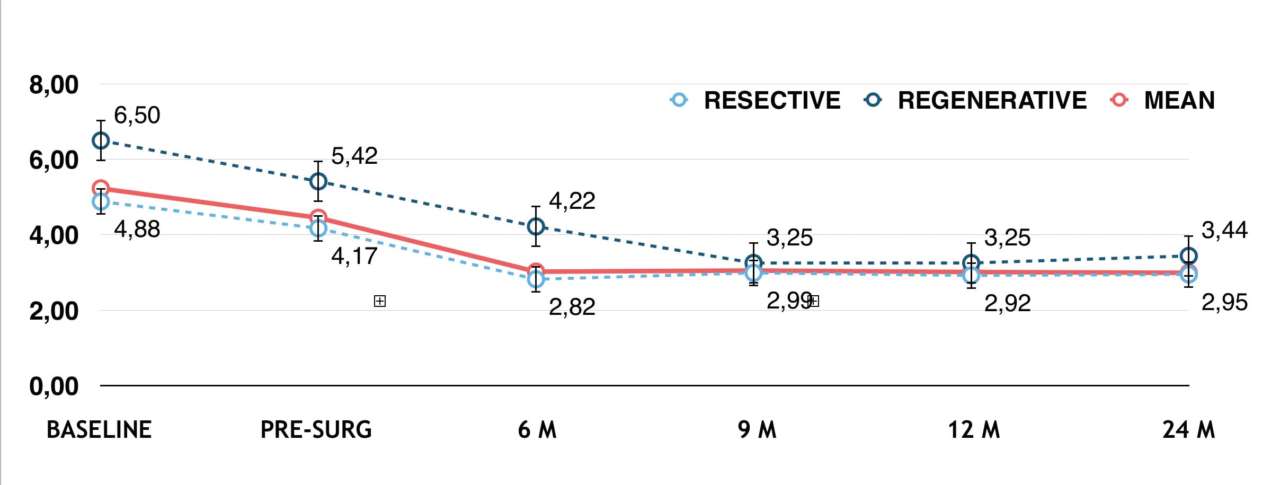 Рис. 3 — Глубина зондирования (PD) в мм
Рис. 3 — Глубина зондирования (PD) в мм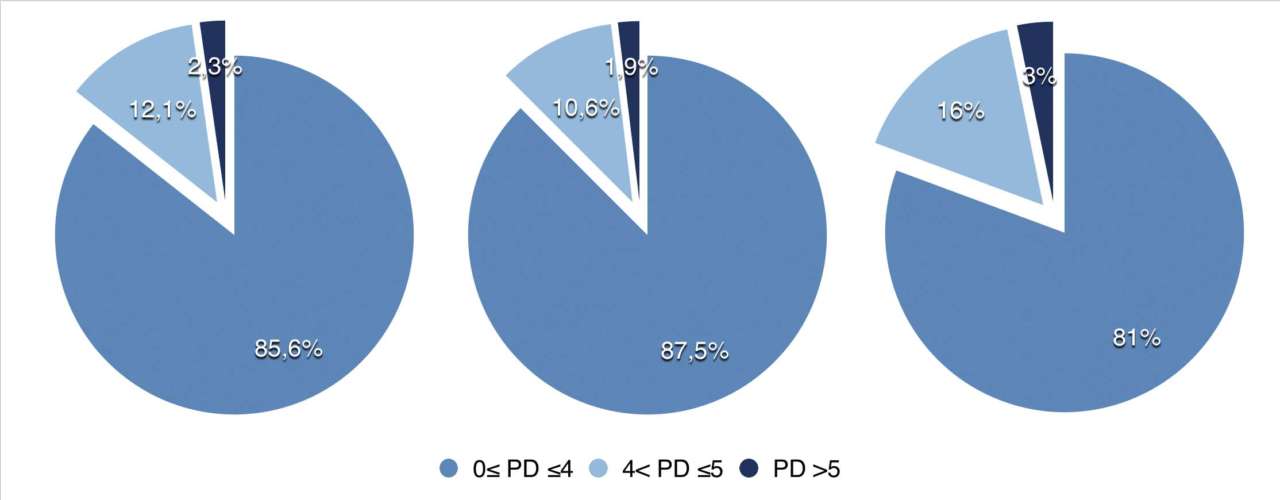 Рис. 4. Распределение значений глубины зондирования (PD) в мм, после операции
Рис. 4. Распределение значений глубины зондирования (PD) в мм, после операции
Для того чтобы оценить эффективность терапии, значения PD на исходном уровне, при повторной оценке после нехирургического лечения, через шесть месяцев после операции и при последующих наблюдениях были зарегистрированы для каждого пациента в четырех периимплантатных участках (дистальном, вестибулярном, мезиальном и нёбном).
Статистический анализ значений зондирования проводился с помощью t-теста Stud ent’s t-test с применением уровня значимости P = 0, 05; кроме того, для значений PD, выраженных в миллиметрах, были рассчитаны средние значения, проценты и стандартные отклонения.
Результаты
За период наблюдения было зарегистрировано три сбоя. В первом случае пациентка в возрасте 59 лет, курильщица и с историей пародонтита, представила имплантат в участке 4.6, пораженный периимплантитом с инфракостным дефектом: через две недели после восстановительного хирургического лечения, связанного с имплантопластикой, наблюдалась дегисценция операционной раны и, как следствие, отсутствие заживления первым намерением.
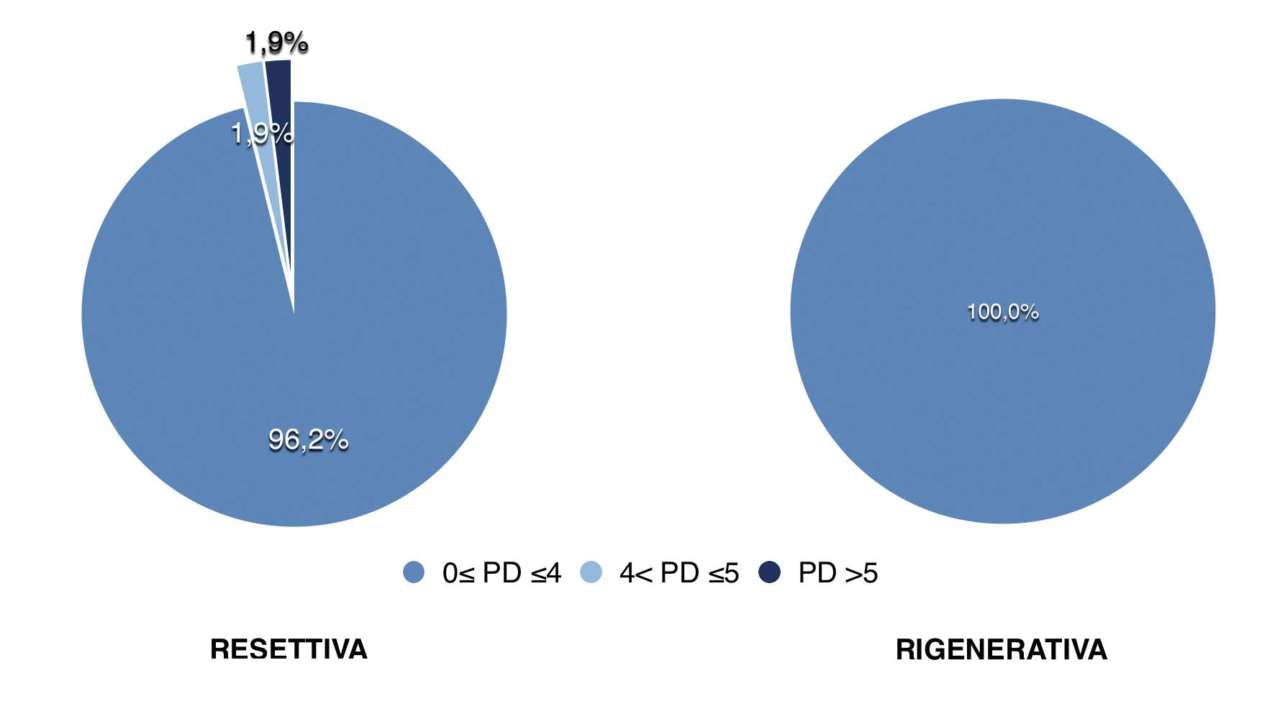 Рис. 5 — Распределение значений глубины зондирования (PD) в мм, 9-месячное наблюдение
Рис. 5 — Распределение значений глубины зондирования (PD) в мм, 9-месячное наблюдение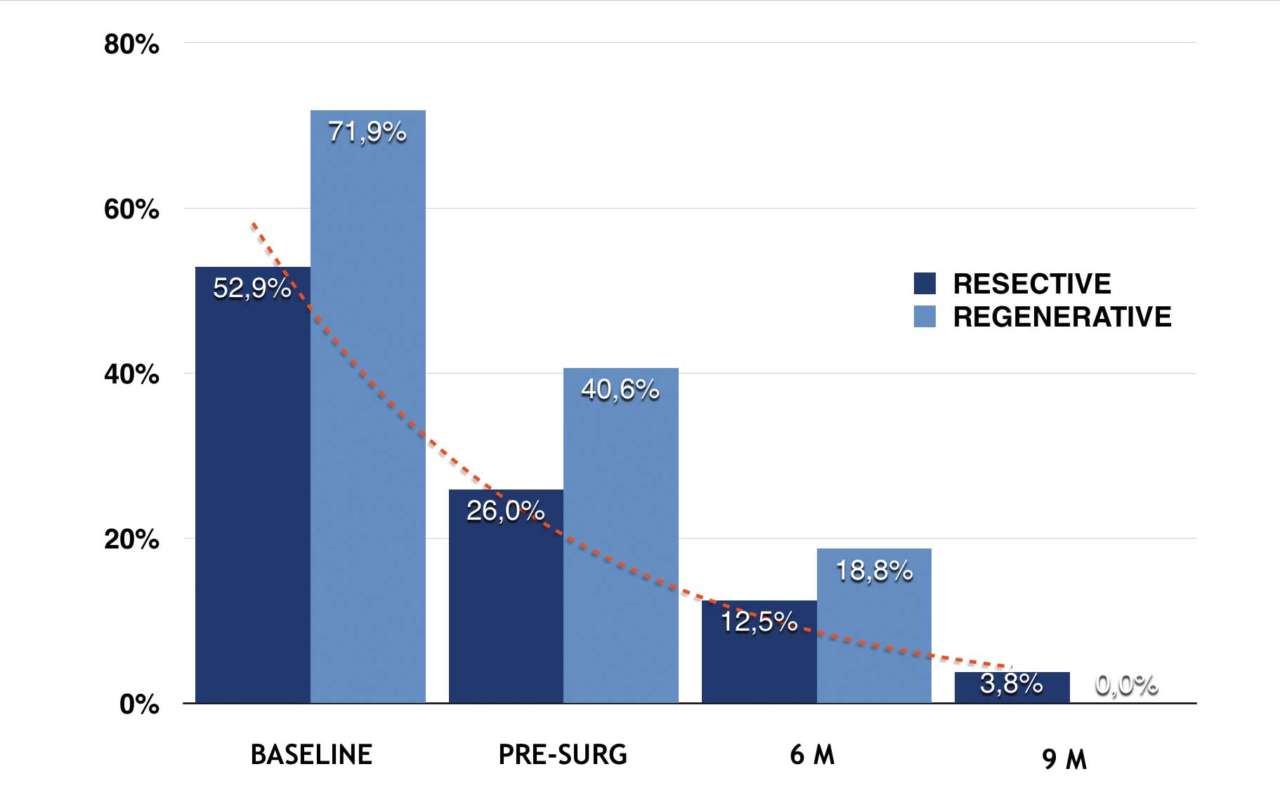 Рис. 6 — Процент участков с глубиной зондирования (PD) ≥5 мм, 9-месячное наблюдение
Рис. 6 — Процент участков с глубиной зондирования (PD) ≥5 мм, 9-месячное наблюдение
Через четыре месяца появился гнойный экссудат и дальнейшая резорбция кости, и было решено удалить имплантат; можно предположить, что неудача терапии была связана с дегисценцией раны и, как следствие, загрязнением трансплантата.
Во втором случае у пациентки в возрасте 65 лет, курящей, с историей пародонтита, был установлен имплантат в участке 2.4, пораженный периимплантитом. Примерно через два с половиной года после резекционного хирургического лечения в сочетании с имплантопластикой наблюдались кровотечение при зондировании, гнойный экссудат и дальнейшее прогрессирование резорбции кости.
Затем имплантат был удален при регенерации дефекта гетерологичным костным заменителем (Bio-Oss® Collagen, Geistlich, Wolhusen, Швейцария): позже был установлен новый имплантат. В данном случае воздействие двух показателей риска, таких как курение и предшествующий пародонтит, может объяснить неудачу терапии.
Третья неудача была зарегистрирована у 48-летнего пациента-мужчины, курильщика, без истории пародонтита, у которого имплантат в участке 1.4 был поражен периимплантитом: через три недели после восстановительного хирургического лечения в сочетании с имплантопластикой наблюдалось загрязнение трансплантата, который был удален в результате повторного хирургического вмешательства. Хотя лечение было признано неудачным, при наблюдении в течение одного года глубина зондирования (ГЗ) была в пределах 4 мм (средняя ГЗ на исходном уровне 5, 5 мм, средняя ГЗ при последнем наблюдении 3, 5 мм), кровотечения не было, а профиль кости был стабильным.
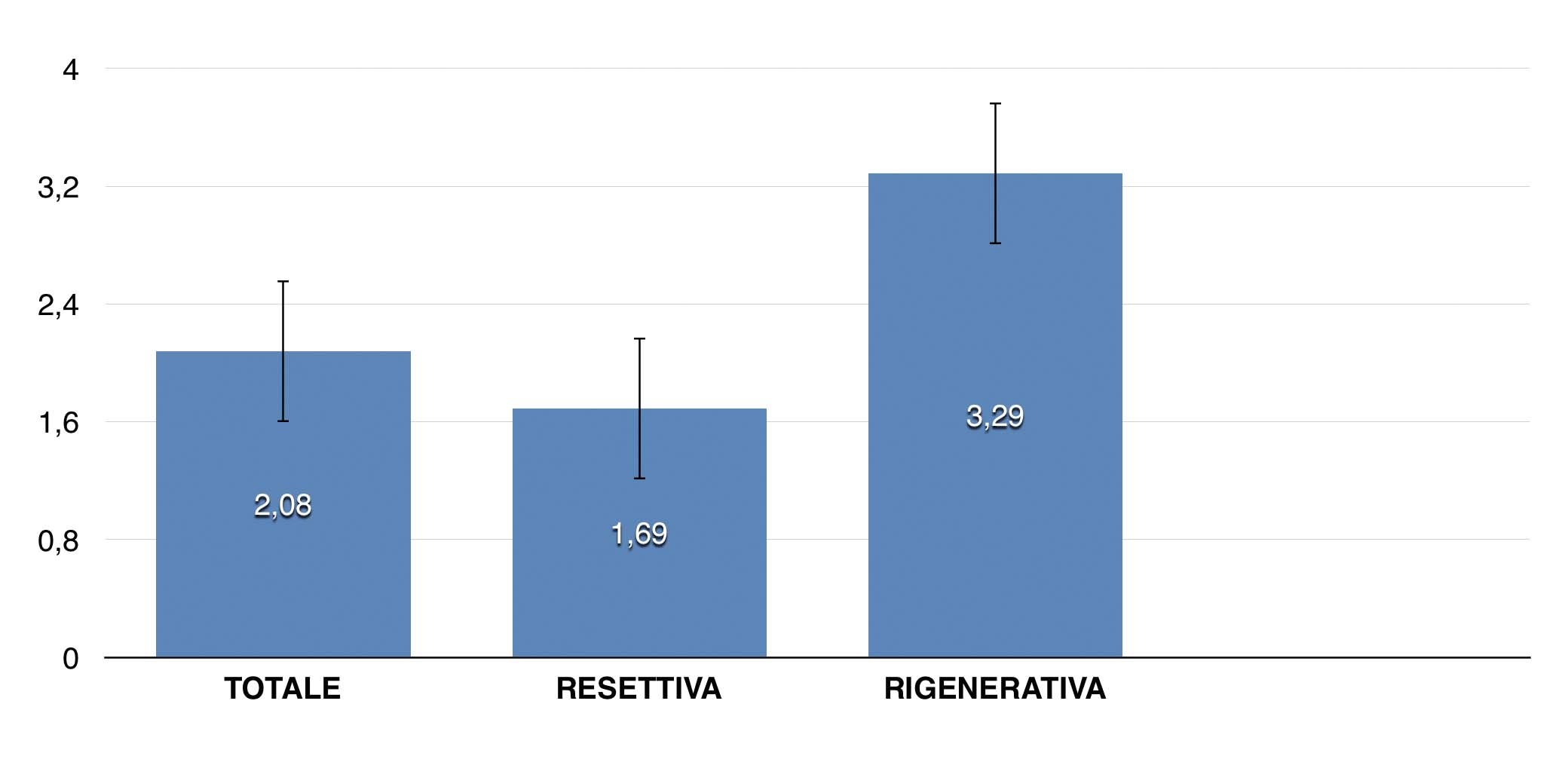 Рис. 7 — Среднее уменьшение глубины зондирования (PD) в мм, 9-месячное наблюдение
Рис. 7 — Среднее уменьшение глубины зондирования (PD) в мм, 9-месячное наблюдение
Через девять месяцев после хирургического лечения на 33 имплантатах, включенных в наше наблюдение, постоянно регистрировался BoP менее 25% и не наблюдалось никаких дальнейших признаков воспаления, таких как покраснение и отек; кроме того, эндоральные рентгенограммы показали стабильный уровень кости по сравнению с послеоперационным. На исходном уровнесреднее значение PD составляло 5, 23 ± 2, 14 мм, а карманы > 5 мм присутствовали в 59, 1% участков.
При повторной оценке после операции среднее значение PD составило 4, 45 ± 2, 11 мм при среднем снижении на 0, 5 ± 1, 67 мм (P = 0, 0010; P 5 мм. Через девять месяцев после операции средний PD составил 3, 05 ± 0, 89 мм, а участки с PD > 5 мм составили 1, 5% от общего числа.
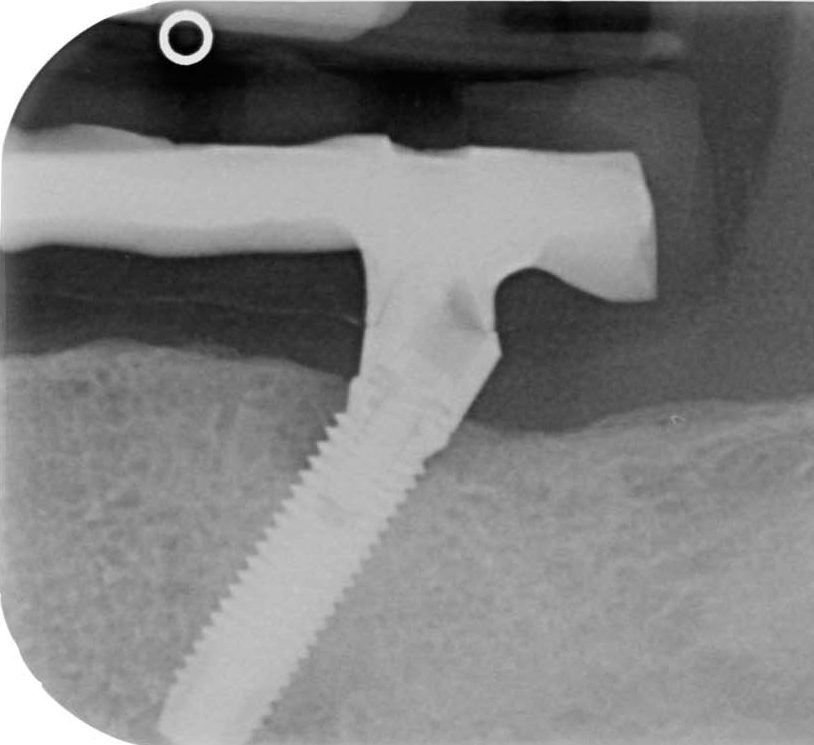 A
A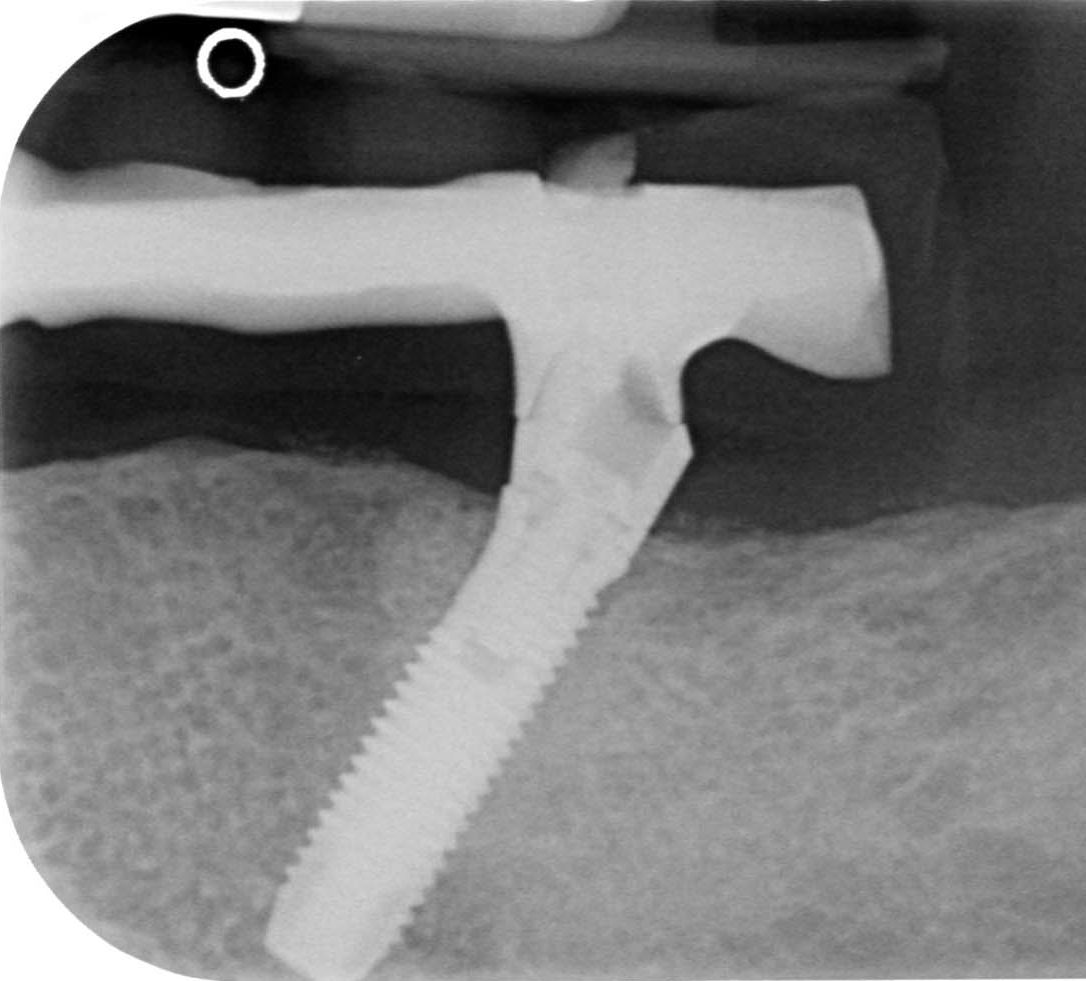 B
B
Рис. 8 — Клинический случай с применением регенеративного подхода.
A) эндоральная рентгенограмма до операции;
B) эндоральная рентгенограмма через 18 месяцев после операции
Анализируя только случаи, в которых проводилось резекционное хирургическое лечение, средний PD составил 2, 99 ± 0, 95 мм, а участки с PD > 5 мм составили 1, 9% от общего числа; в случаях, в которых проводилось регенеративное хирургическое лечение, средний PD составил 3, 25 ± 0, 65 мм, а PD > 5 мм не был обнаружен ни в одном участке. При анализе значений глубины зондирования (PD), полученных до и после операции, были отмечены статистически значимые различия для каждого из четырех участков у каждого пациента, а также для всех участков и пациентов (P Обсуждение
Данные, представленные в настоящем исследовании, частично совпадают с теми, что были представлены в литературе. Romeo et al. 3, 4 обнаружили у 19 имплантатов, пролеченных с помощью резекционной операции, средние значения PD 5, 79 мм, 3, 38 мм, 3, 43 мм, 3, 58 мм, соответственно, в исходном состояниии в контроле через шесть месяцев, один год и два года, при этом выживаемость в течение трех лет составила 100%.
Аналогично, средние значения PD, зарегистрированные в нашем наблюдении, составили 4, 88 ± 1, 95 мм в исходном состоянии (26 имплантатов), 2, 82 ± 1, 36 мм через шесть месяцев, 2, 92 ± 0, 95 мм через один год и 2, 95 ± 1, 03 мм через два года (19 имплантатов), при этом выживаемость составила 100% через один год и 96, 2% через два года.
Pommer et al.8 сообщили о частоте неудач в 13% (46 имплантатов) у пациентов, получавших только имплантацию, и 17% (24 имплантата) в сочетании с лазером при девятилетнем наблюдении; однако частота успеха при однолетнем и двухлетнем наблюдении составила 100% в один год и 97, 9% в два года.
Schwarz et al.9 оценили семилетние результаты после резекционного или регенеративного хирургического лечения в сочетании с имплантацией с использованием двух методов обеззараживания поверхности (Er:YAG лазер [ERL] или пластиковые кюретки и ватные гранулы с физраствором [CPS]) у 15 пациентов; обе группы достигли схожих результатов в плане снижения клинического уровня прикрепления, т.е. 2, 06 мм при резекционном подходе к дефекту и 2, 76 мм при регенеративном подходе. Средние значения PD составили 5, 78 мм для PCD и 4, 78 мм для ERL в исходном состоянии и 3, 55 мм и 4, 04 мм соответственно через семь лет.
В двух недавних обзорах литературы сообщалось о снижении ПД на 2, 04 мм при резективной операции (Chan et al.10 ) и на 2, 78 мм при регенеративной операции (Daugela et al.11 ).
Регенеративный и резекционный подходы дали значительную разницу в снижении PD, что частично объясняется тем, что исходные значения PD в инфракостных дефектах были выше, чем в супракостных (рис. 6).
Выводы
Хирургическое лечение периимплантита преследует цели устранения периимплантитных карманов и улучшения доступа для домашней гигиены полости рта: в зависимости от анатомии костного дефекта есть показания для резекционного или регенеративного хирургического подхода.
В данном исследовании оба хирургических подхода сочетались с имплантопластикой, чтобы сделать поверхность имплантата менее ретенционной к налету.
Следует отметить, что наличие костных стенок, наклон имплантатов и невозможность удаления компонентов протеза могут затруднить доступ к поверхности имплантата и, следовательно, препятствовать проведению полной и однородной имплантопластики; поэтому данная процедура, даже если она выполняется с помощью инструментов оптического увеличения, в значительной степени зависит от оператора.
Несмотря на небольшую выборку пациентов и ограниченное время наблюдения, полученные результаты можно считать обнадеживающими.
В результате хирургического лечения был достигнут контроль над воспалением без прогрессирования периимплантита в плане увеличения резорбции кости. Более того, остаточная глубина зондирования (в среднем 3, 05 ± 0, 89 мм) после лечения была совместима с домашней гигиеной полости рта: таким образом, метод имплантопластики, по-видимому, был эффективен в борьбе с бактериальным налетом, без каких-либо эпизодов металлоза или других системных осложнений, связанных с самой процедурой.
В заключение, имплантация в сочетании с хирургическим лечением периимплантита является многообещающим терапевтическим подходом, который нуждается в дальнейшем изучении на более крупных выборках пациентов и при более длительном наблюдении.
Авторы заявляют об отсутствии конфликта интересов, экономических или иных, в отношении представленной статьи.
Corrispondenza
luca.francetti@unimi.it
Эффективность имплантопластики в хирургическом лечении периимплантита: серия случаев
Резюме
Цели. Наблюдать клинические эффекты имплантопластики при различных хирургических подходах, таких как резекционная и регенеративная хирургия.
Материал и методы. 15 пациентов с 34 имплантатами, пораженными периимплантитом, были включены в исследование в течение 30 месяцев.
За 6-8 недель до хирургического лечения все пациенты прошли курс нехирургической терапии. Имплантопластика была связана с резекционным или регенеративным хирургическим подходом в зависимости от типа дефекта. Все пациенты были повторно оценены через 9 месяцев после операции.
Результаты. За исключением трех зарегистрированных неудач, через 9 месяцев после операциивсе имплантаты не имели признаков периимплантатного воспаления, средняя глубина зондирования составила 3, 05 ± 0, 89 мм при среднем снижении 2, 08 ± 1, 89 мм.
Только в 3, 8% случаев была зарегистрирована глубина зондирования ≥ 5 мм.
Выводы. Имплантопластика, связанная с хирургическим лечением периимплантита, улучшила все клинические параметры и может рассматриваться как обоснованный вариант лечения.
