Цель. Основной целью нашего исследования является оценка, с 5-летним наблюдением, успеха и выживаемости имплантатов, установленных пациентам, прошедшим радиотерапию по поводу рака области головы и шеи, для обеспечения руководства в клинической деятельности по планированию хирургического имплантата
Материал и методы. Десять пациентов с диагнозом опухоли головы и шеи, проходящих радиотерапию, были отобраны для установки в общей сложности 39 эндо-костных имплантатов. Установка имплантатов проводилась после заживления остатков зубов с целью устранения всех инфекционных очагов в полости рта и не менее чем через год после лучевой терапии. Реабилитация с опорой на имплантаты проводилась с помощью накладных протезов с шинами или без них. Оценивались показатели успешности и выживаемости всех установленных имплантатов. Выживаемость отслеживалась с течением времени посредством клинического контроля и радиографических исследований через 3, 6 и 12 месяцев.
Результаты. Один пациент, которому было установлено 4 имплантата, был исключен из исследования в связи со смертью. Три имплантата не соответствовали прогнозируемому уровню успеха и выживаемости; остальные 32 были полностью интегрированы и соответствовали прогнозируемым критериям во время последующего наблюдения, что составило 91, 4% успеха и 94, 2% выживаемости имплантатов.
Заключение. Полученные данные позволяют утверждать, что имплантология для поддержки протезов является эффективным методом реабилитации пациента, прошедшего радиотерапию. Показатели успешности и выживаемости, в соответствии с данными литературы, всегда должны быть связаны с количеством установленных имплантатов и строгими критериями исключения, предусмотренными протоколом.
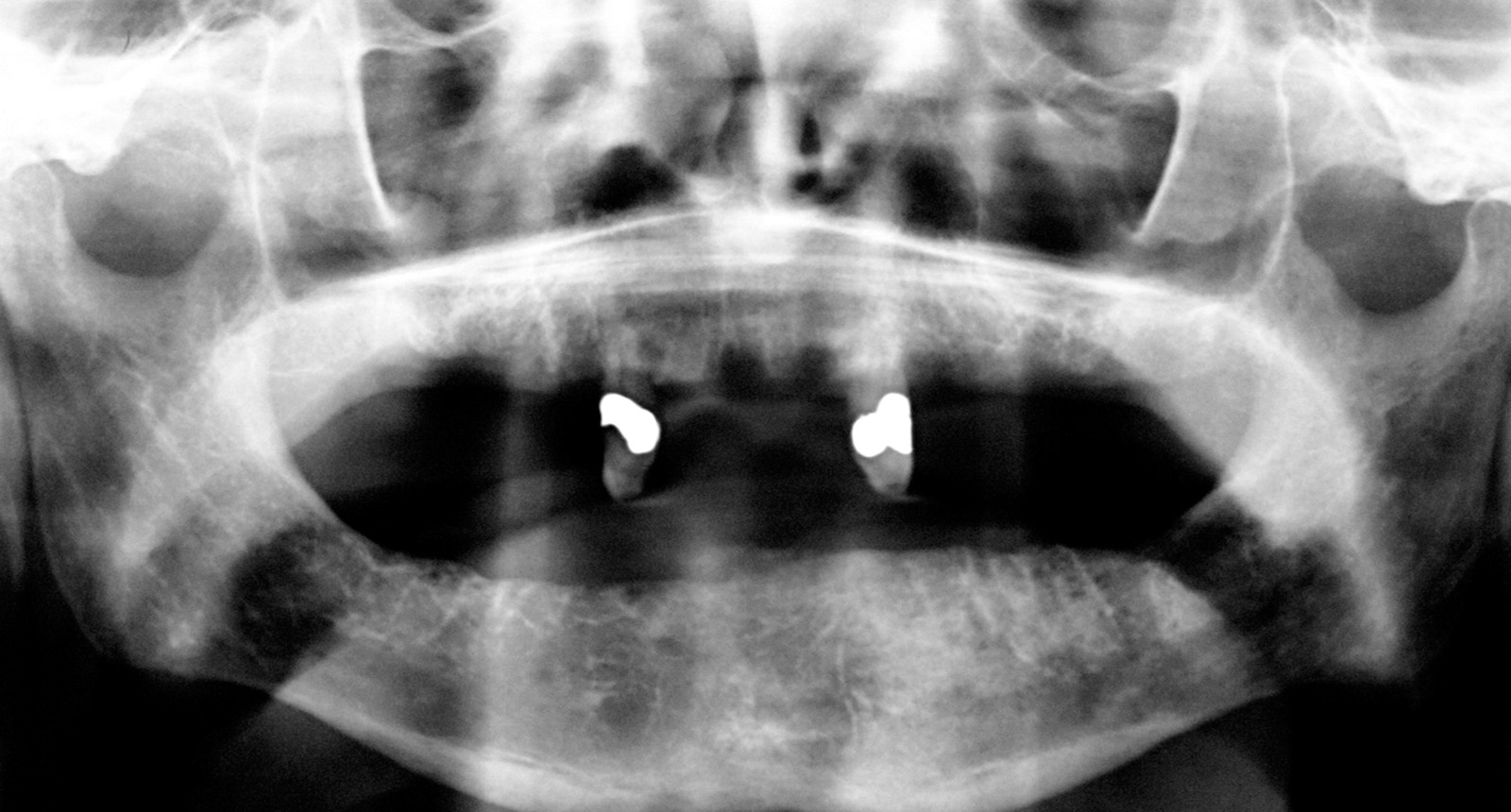 1. Предоперационная ОПТ.
1. Предоперационная ОПТ.
Терапевтические процедуры при новообразованиях головы и шеи приводят к дефектам мягких и твердых тканей, дисфункциональности и эстетическим изменениям. По этой причине реабилитация с помощью обычных протезов довольно затруднительна; в этой ситуации имплантология представляет собой реальную альтернативу для восстановления правильной жевательной функции, эстетики и фонетики. Большие челюстно-лицевые дефекты обычно лечатся с помощью реваскуляризированных свободных лоскутов, которые в сочетании с радиотерапией создают серьезные проблемы с точки зрения удержания и стабильности протезов. Лучевая терапия в челюстно-лицевой области может привести к мукозиту, ксеростомии, повышенной восприимчивости к инфекции, замедленному заживлению и остеорадионекрозу1, 2 . Изначально радиотерапия считалась абсолютным противопоказанием для установки остеоинтегрированных имплантатов у онкологических пациентов3 . Тем не менее, в последующие годы многие клиницисты встали на этот экспериментальный путь, что вызвало интенсивную дискуссию с часто противоречивыми результатами 4-6 . В литературе нет единого мнения относительно идеального времени для вмешательства после облучения, сколько и какая дозировка влияет на выживаемость имплантата, можно ли проводить облучение после установки имплантата, препятствует ли химиотерапия остеоинтеграции, необходима ли гипербарическая кислородная терапия. В настоящее время имплантология является важным ресурсом для восстановления функции и эстетики полости рта у частично или полностью беззубых пациентов с тканями, нарушенными в результате лечения рака полости рта5, 7, 8 .

 Основной целью нашего исследования является оценка, с 5-летним наблюдением, успеха и выживаемости имплантатов, установленных пациентам, прошедшим радиотерапию по поводу рака головы и шеи, путем сопоставления результатов с результатами, представленными в последних поступлениях в международной литературе. Вторичная цель — дать рекомендации по клинической деятельности планирования хирургической имплантации в свете полученных результатов.
Основной целью нашего исследования является оценка, с 5-летним наблюдением, успеха и выживаемости имплантатов, установленных пациентам, прошедшим радиотерапию по поводу рака головы и шеи, путем сопоставления результатов с результатами, представленными в последних поступлениях в международной литературе. Вторичная цель — дать рекомендации по клинической деятельности планирования хирургической имплантации в свете полученных результатов.
Материалы и методы
Отбор образцов
С сентября 2000 г. по июнь 2004 г. в нашем отделении проходили лечение 48 пациентов в возрасте от 39 до 77 лет (среднее значение 65 лет) с диагнозом неопластические поражения полости рта и ротоглотки. В нашем исследовании гистопатологическое исследование каждого пациента выявило плоскоклеточную карциному у 38 пациентов (79, 1%), карциному слюнных желез у 7 пациентов (14, 5%) и веррукозную карциному у остальных 3 пациентов (4, 25%).25%); анатомическими участками, наиболее пораженными неоплазией, были язык (16 пациентов) и ретромолярный тригон (11 пациентов) с долей 33, 3% и 22, 9% соответственно, затем ротоглотка 16, 6% (8 пациентов), дно полости рта 14, 6% (7 пациентов) и альвеолярная слизистая 12, 5% (6 пациентов) (таблицы 1, 2).
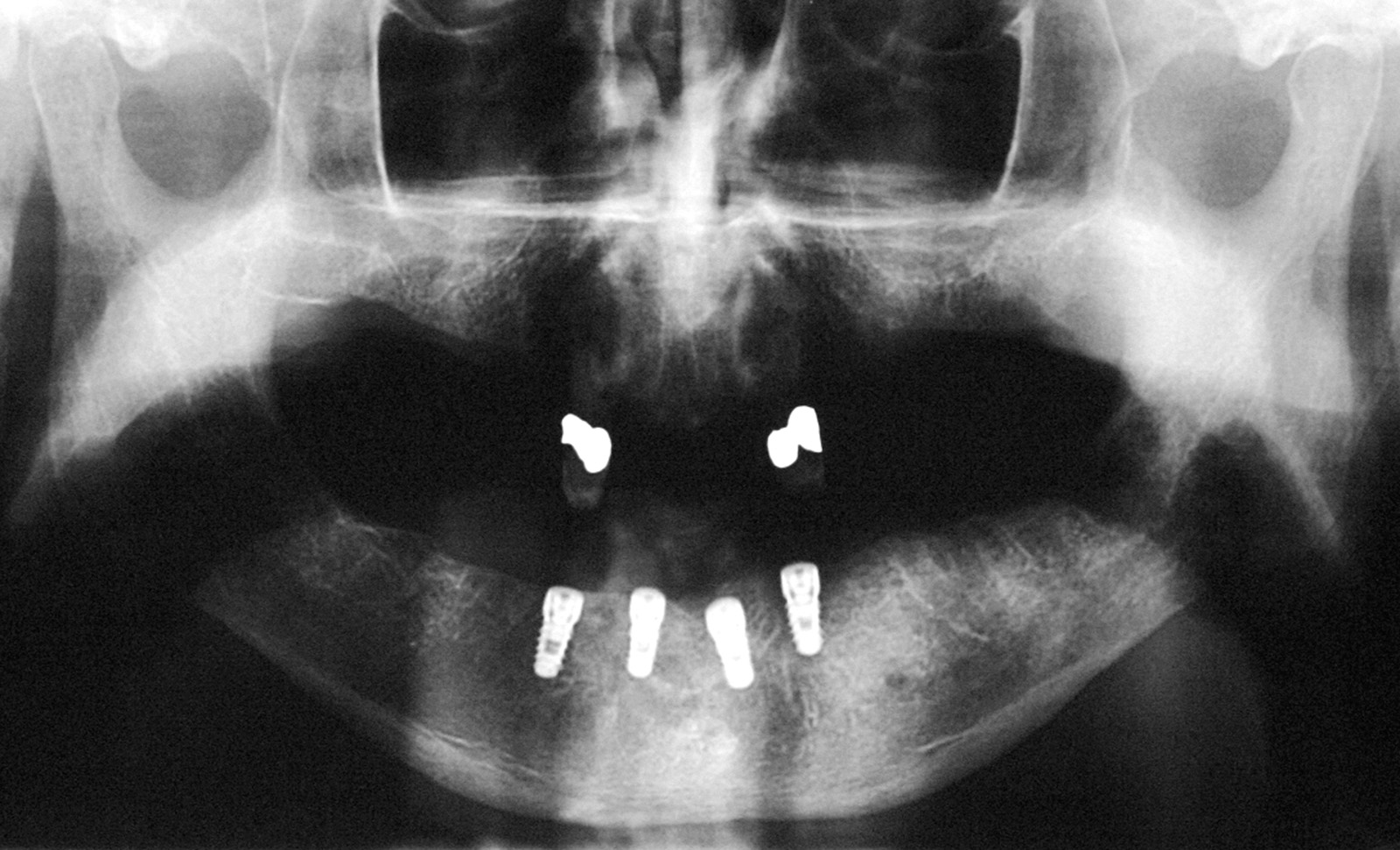 2. ОПТ после операции по установке имплантата.
2. ОПТ после операции по установке имплантата.
Протоколы лечения включают, помимо облучения, резективную и реконструктивную хирургию (с использованием или без использования реваскуляризированных свободных лоскутов) и химиотерапию. Они были составлены на основании клинических, инструментальных (ПЭТ, магнитно-резонансная томография, томография) и гистологических (биопсия) обследований всех пациентов. Заключительная фаза этих протоколов включает в себя проект имплантации-протезирования с целью восстановления функции и эстетики полости рта этих пациентов, улучшения качества их жизни. Отбор пациентов проводился с большой осторожностью, так как имплантаты, установленные в облученную кость, показывают более высокую частоту неудач 2, 5, особенно при наличии высоких суммарных доз, особенно в случаях, когда не соблюдаются необходимые временные интервалы между лучевой терапией и операцией по установке имплантата 1 . По этой причине строгие критерии исключения, представленные:
— наличие рецидива;
— системные патологии, влияющие на процессы заживления (атеросклероз, диабет, иммунодефициты. ..);
— плохое количество и качество остаточной кости;
— плохая гигиена полости рта;
— испорченные привычки (курение, алкоголь…);
— радиотерапия после реконструкции;
— недостаточная доступность ротовой полости.
Исходя из этих предпосылок, в исследование были отобраны 10 пациентов, которым было установлено в общей сложности 39 эндо-костных имплантатов.
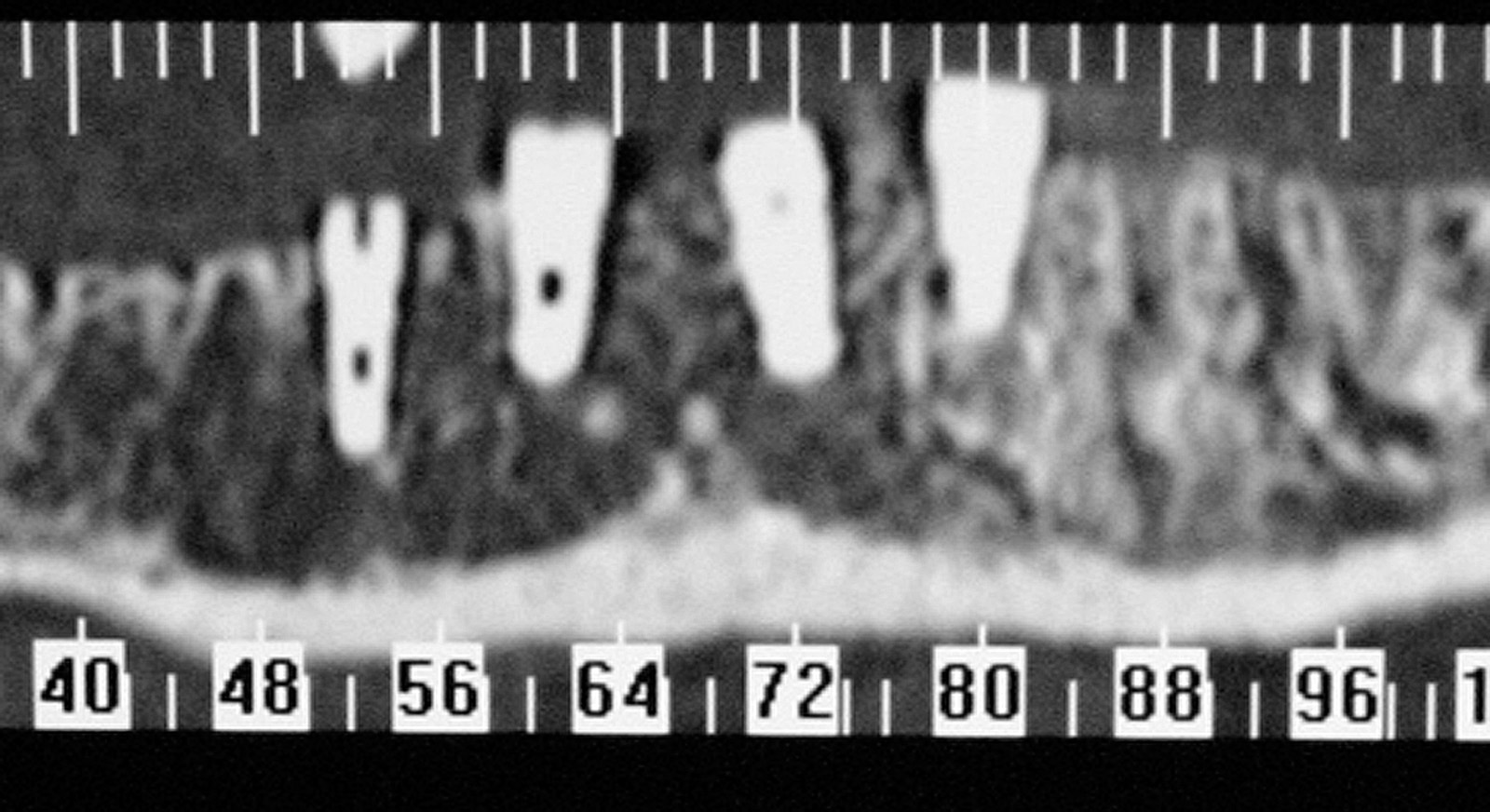 3. Детали компьютерной томографии.
3. Детали компьютерной томографии.
Хирургическая процедура
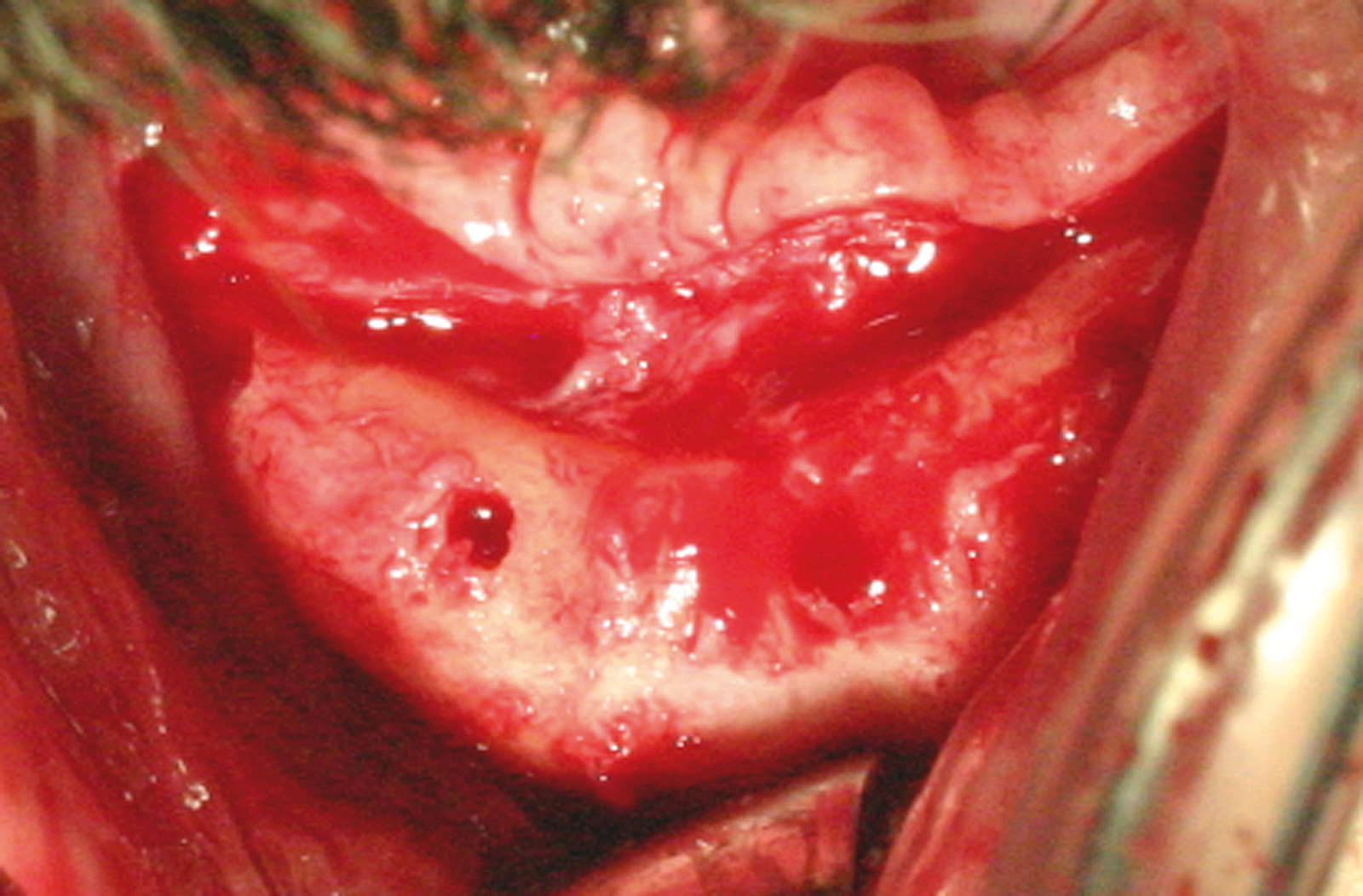
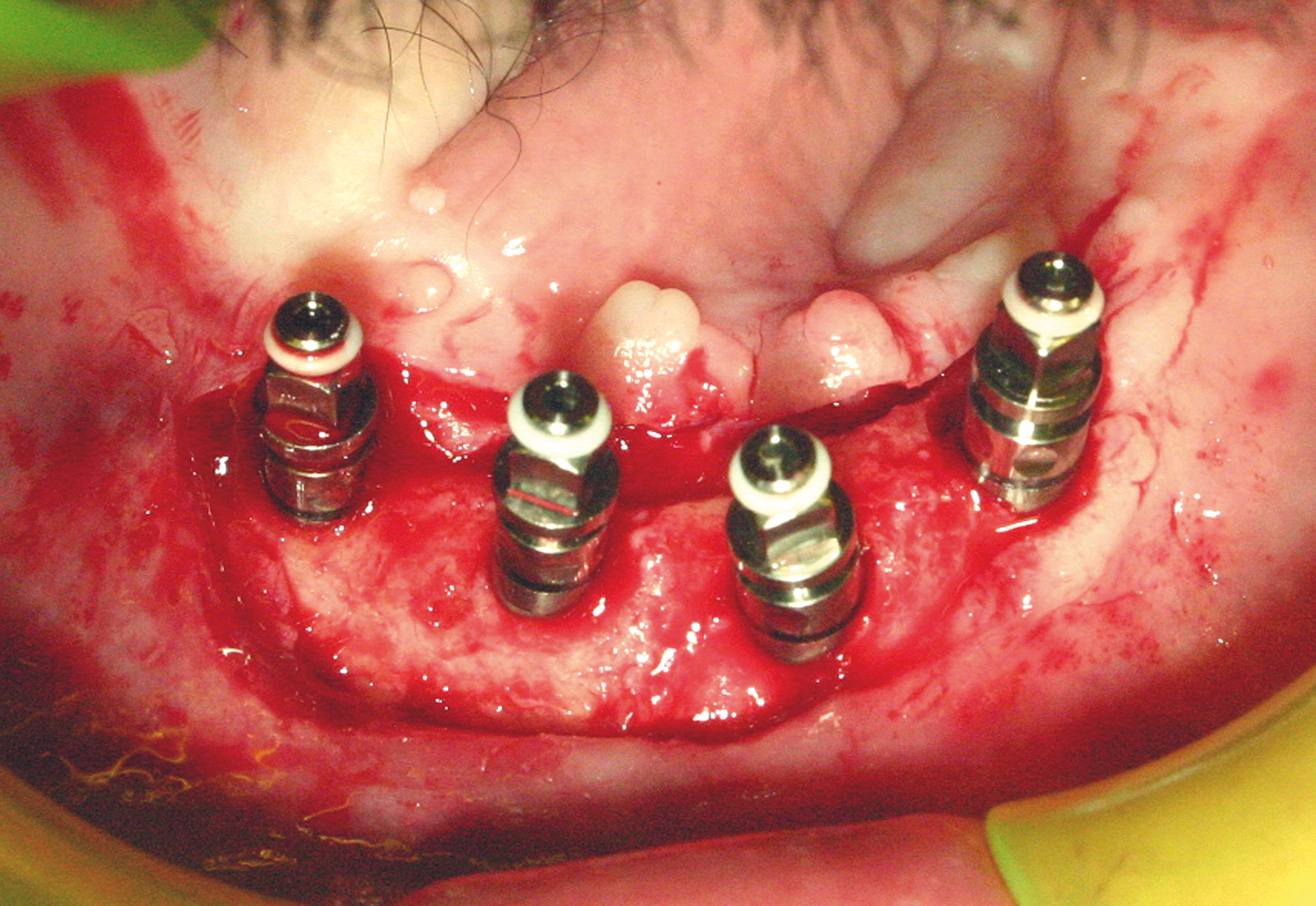
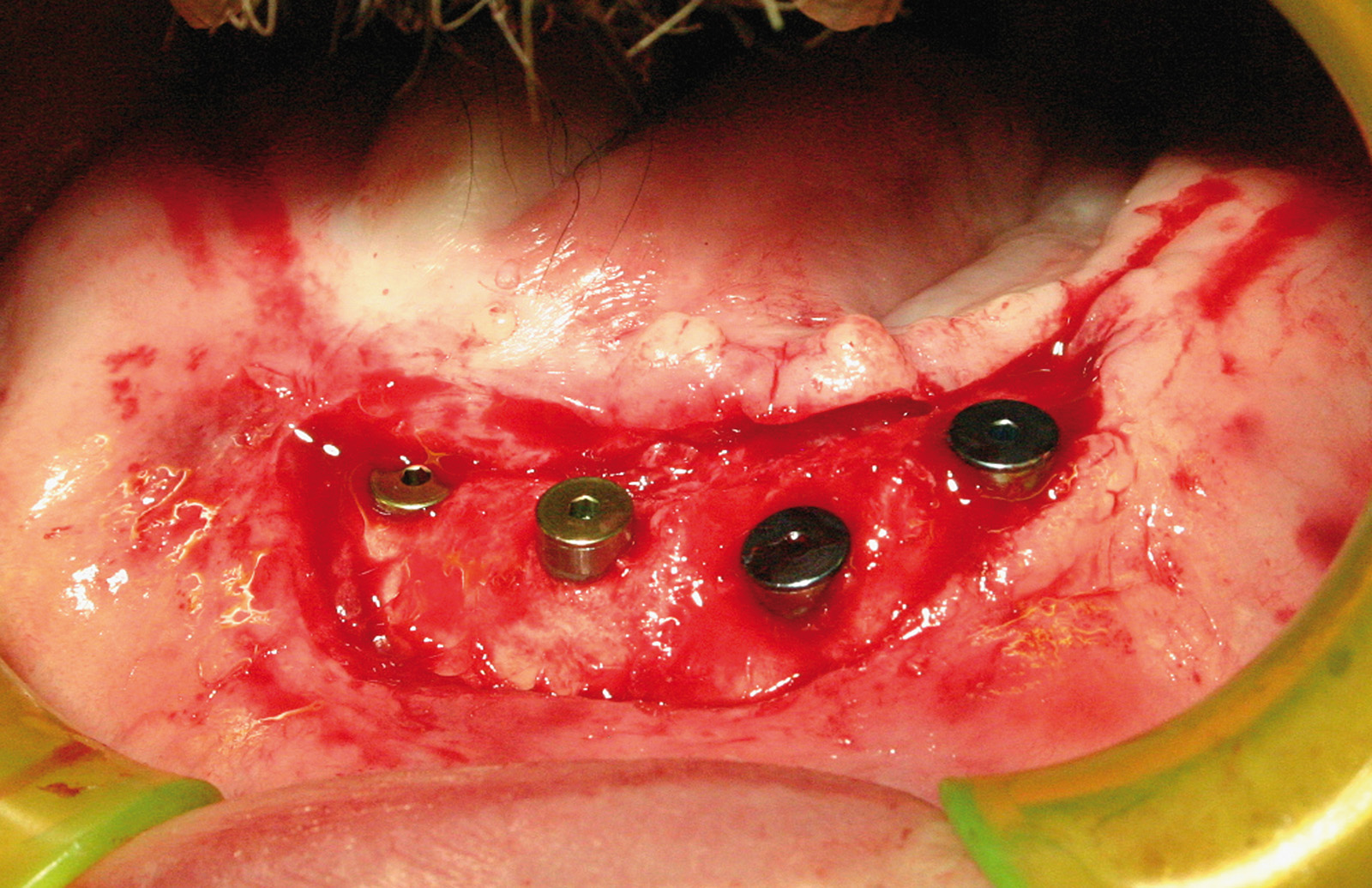
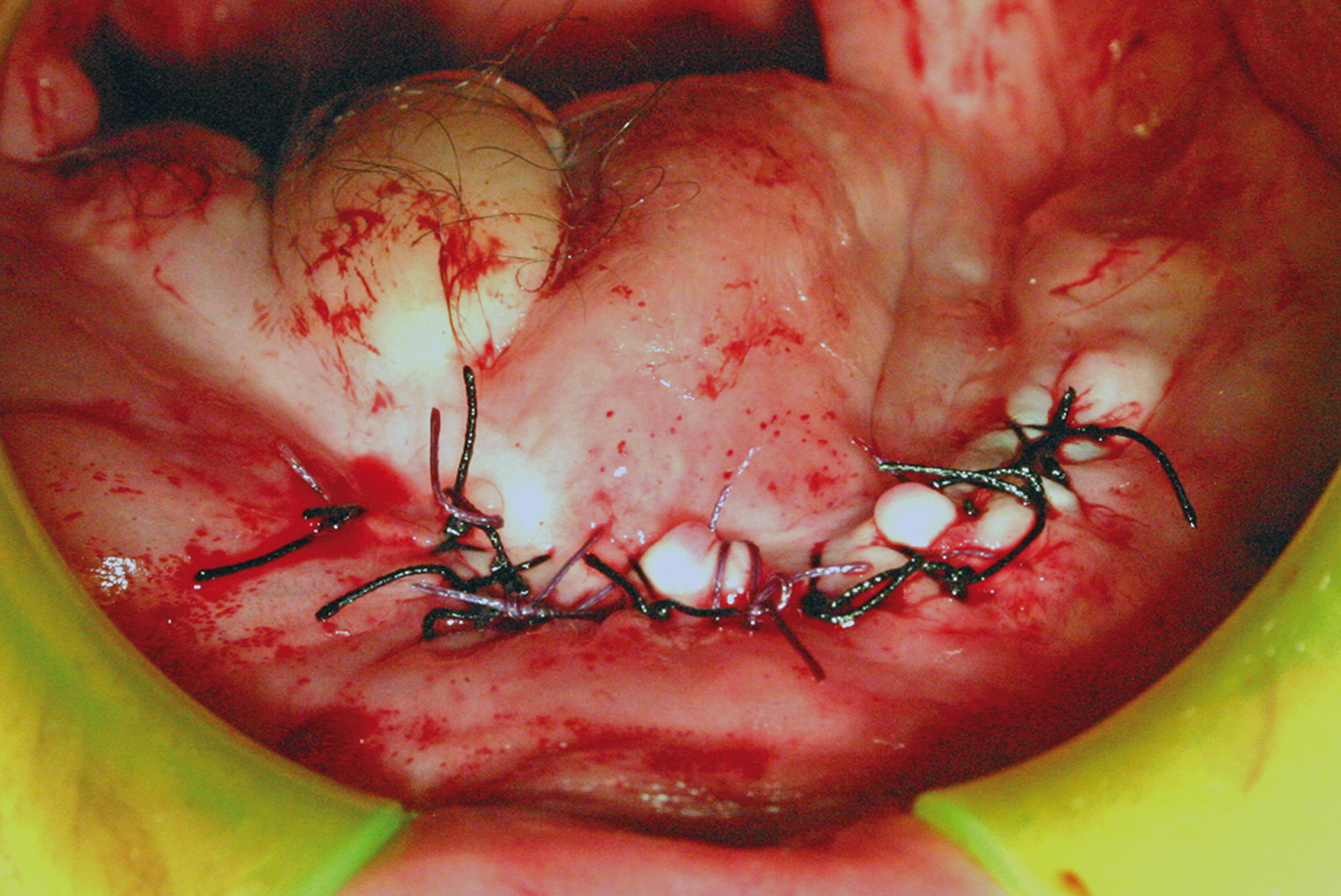
Установка имплантатов проводилась после заживления остатков зубов, чтобы устранить все инфекционные очаги в полости рта (рис. 1). Последующая реабилитация с опорой на имплантаты проводилась с помощью накладных протезов с или без балок (рис. 2-3). Для всех пациентов временной интервал между лучевой терапией и операцией по установке имплантата (рис. 4-7) составил 12 месяцев:
— антибиотикотерапия амоксициллин-клавулановой кислотой cpr 1 г каждые 12 часов за две недели до и одну неделю после установки имплантата;
— полоскание рта 0, 2% хлоргексидина диглюконатом до операции и в течение 10 дней после нее;
— 100 мг Нимесулида за 1 час до операции. Противовоспалительные НПВС будут приниматься по мере необходимости пациента с максимальным приемом 100 мг каждые 8 часов в течение максимум 7 дней;
— мепивакаин 3% локо-региональная анестезия без вазоконстриктора после удаления лоскута полной толщины с гребневым разрезом;
— хирургический маневр как можно более атравматично;
— Шелковый шов 3/0 удален через неделю после операции.

Данные и последующие действия
Показатели выживаемости и успешности были оценены для всех установленных имплантатов. Критерии успеха имплантации 9 учитывали как сложные хирургические и ортопедические условия, так и нарушенные анатомические условия и были представлены следующими критериями:
— отсутствие подвижности имплантата;
— отсутствие воспаления, абсцессов или свищей в периимплантатных тканях;
— отсутствие боли в месте имплантации;
— отсутствие периимплантационной радиопрозрачности;
— периимплантатная резорбция кости менее одной трети длины имплантатов.
Выживаемость имплантатов отслеживалась с течением времени посредством клинического контроля (рисунок 8) и рентгенографических исследований в соответствии со сроками:
— каждые 3 месяца в течение первого года;
— каждые 6 месяцев на втором и третьем году;
— каждые 12 месяцев на четвертый и пятый год
Успех и выживаемость имплантатов были проанализированы и сравнены с последними данными из обзора международной литературы.
Результаты, полученные в данном исследовании после сбора данных, обобщены в таблице 3.
Один пациент из исследуемой выборки, из-за развившихся впоследствии метастазов опухоли, не посещал последующие визиты, предусмотренные протоколом, и поэтому был исключен из исследования. Поэтому исследование было проведено на всех 35 имплантатах у оставшихся 9 пациентов. У одного из этих пациентов, которому было установлено три имплантата в симфизарной области, один имплантат вышел из строя во время первого контрольного посещения, а у другого пациента один из четырех установленных имплантатов был удален из-за осложнения в виде остеорадионекроза вокруг раны имплантата. Один имплантат в конце четвертого года показал периимплантатную радиопрозрачность, связанную с резорбцией кости более чем на треть своей длины, но это не повлияло на его функциональный успех для целей протезирования, что было подтверждено при заключительном осмотре через 5 лет. Остальные 32 были полностью интегрированы и соответствовали критериям во время последующего наблюдения, при этом процент успеха составил 91, 4%, а выживаемость имплантата — 94, 2%.
Обсуждение
Лучевая терапия может оказывать важное влияние на показатели успешности имплантации, особенно при дозах облучения свыше 55 Гр2, 5, 10, 11 . Некоторые авторы предполагают, что безопасный порог для имплантационной терапии составляет менее 55 Гр 6 . Гранстром в исследовании 2006 года также указывает, что доза в Гр сама по себе вводит в заблуждение, поскольку она не дает информации о количестве проведенных фракций, которые способствуют «кумулятивному радиационному эффекту»; последний был бы более надежным параметром для количественной оценки реальной радиации, которой подвергается пациент. В литературе, однако, нет единого мнения об идеальном времени ожидания после радиотерапии до операции; на самом деле, перед лицом тех, кто теоретизирует необратимые последствия постлучевых поражений, некоторые авторы утверждают, что интервал в 1 год позволяет частично восстановить ткани 12 , в то время как другие авторы рекомендуют интервал в 6 месяцев, чтобы обеспечить достаточную реваскуляризацию 5, 8 . Облучение, применявшееся до недавнего времени, казалось, оказывало более негативное влияние на выживаемость имплантатов, чем последние методы радиотерапии. Это связано с типом используемого излучения, которое было низкоэнергетическим в отличие от современного высокоэнергетического излучения. Показатели успеха тесно связаны с выбором времени установки имплантатов, в то время как они не изменяются от самой лучевой терапии, техники трансплантации или установки в родную или трансплантированную кость. Некоторые исследования также анализируют характеристики имплантатов у пациентов, прошедших радиотерапию, показывая, что использование коротких имплантатов не рекомендуется в облученной кости и что частота неудач в этих случаях высока 13 . Что касается мягких тканей, то следует сказать, что хотя наличие определенного количества прилегающей десны рассматривается многими авторами как необходимое условие для здоровья периимплантатных тканей, с расширением показаний к имплантологии в более сложных ситуациях отсутствие прилегающей десны не является столь критичным, как считалось ранее 14 . Конечно, у таких пациентов часто хрупкие слизистые оболочки, что нередко приводит к мукозиту различной степени, сохраняющемуся в течение длительного времени после лучевой терапии.
 8. Реабилитация с помощью готового нижнего протеза.
8. Реабилитация с помощью готового нижнего протеза.
Трение от протезов повышает риск травмы, которая может перерасти в остеорадионекроз 15, 16 . August et al. 1998 17 сообщают о ряде проблем с мягкими тканями у пациентов, прошедших радиотерапию и реабилитированных с помощью нижнечелюстных имплантатов. Ранние осложнения включают языковые язвы, разрастание мягких тканей и дегисценцию раны; поздние осложнения включают образование свищей. Ватцингер и др.23 сообщили об увеличении частоты гингивита у облученных пациентов. Хотя ортопедическая и функциональная реабилитация беззубых пациентов, прошедших радиологическое лечение, намного сложнее и менее предсказуема, чем у неонкологических пациентов, несколько исследований показывают, что за последние десятилетия произошла эволюция методов реабилитации полости рта у этих пациентов, которые могут добиться успешного лечения с помощью накладных протезов с опорой на имплантаты4, 11 . Поэтому процедура выбора — это использование удерживающих балочных накладных протезов или несъемных протезов с опорой на имплантаты. Эти решения сводят к минимуму биологические осложнения, встречающиеся у таких пациентов 18 . С другой стороны, случаи с меньшей выживаемостью имплантатов были зарегистрированы в тех случаях, когда протезы крепились с помощью крючков и магнитов на консолях 12 . Препятствия представлены искажением анатомии полости рта, изменением качества слизистой оболочки, наличием рубцовой ткани и изменением топографии кости; по этой причине позиционирование имплантатов протезируется в пределах, налагаемых анатомическими условиями. У таких пациентов дефекты, оставшиеся после операции по удалению рака, выходят далеко за рамки потери зубных элементов, поэтому протезы должны разрабатываться и изготавливаться в каждом конкретном случае индивидуально. Исследования в литературе показывают, что процент успеха имплантатов, установленных в облученную кость с или без трансплантации, находится в диапазоне от 85 до 99% 6-8 . Нельсон и др. в исследовании 2007 года 18 показали, что нет существенных различий в выживаемости имплантатов между облученными и необлученными пациентами. Однако они отмечают, что исключили из исследования курильщиков с осложнениями до операции по имплантации. Большинство неудач наблюдалось у пациентов, которым радиотерапия была проведена сразу после установки имплантата. Нельсон описывает ряд поздних неудач, сравнимых в процентном отношении с таковыми у пациентов, не подвергавшихся облучению. В других исследованиях приводятся довольно противоречивые данные относительно количества имплантатов, потерянных после лучевой терапии, которое может достигать 50% 6, 9, 12, 19, 20 . Значительные различия в показателях успеха между имплантатами, установленными в облученную и необлученную кость, подтвержденные несколькими авторами, вероятно, связаны с уменьшением васкуляризации, вызванной радиотерапией, и должны быть связаны с дозой излучения и периодом наблюдения 5, 10, 19-21 . Исследование 1995 года, проведенное Franzen et al.10, показало 95% успех имплантации через 5 лет для 20 имплантатов, установленных в нижней челюсти, что согласуется с предыдущим отчетом Taylor и Worthington в 1993 году24 , в котором 21 имплантат, установленный пациентам, прошедшим радиотерапию, показал нормальную остеоинтеграцию. Также в 1993 году Nimi 22 сообщил о 83% успешности имплантатов через три года после нагрузки протеза. Watzinger et al. в 1996 году 23 сообщили об успешности 87, 3% имплантатов, установленных в облученную кость через три года. Наш показатель успешности 91, 4% соответствует данным этих авторов и в целом данным международной литературы.
Выводы
Наше исследование было проведено для оценки эффективности импланто-протезной реабилитации у пациентов, прошедших радиотерапию после экскреции рака полости рта. В конечном итоге, мы стремимся определить с клинической точки зрения некоторые критерии для достижения успеха у этого типа пациентов. Полученные данные позволяют утверждать, что имплантология для поддержки протезов является эффективным методом реабилитации пациента, прошедшего радиотерапию. Показатели успешности и выживаемости, в соответствии с данными литературы, всегда должны быть связаны с количеством установленных имплантатов и строгими критериями исключения, установленными в протоколе. Учитывая сложность и трудно предсказуемость лечения у данного типа пациентов, мы бы рекомендовали устанавливать не три, а как минимум четыре имплантата у одного и того же пациента, чтобы избежать чрезмерной потери опоры в случае отказа одного из имплантатов, который может изменить первоначальную конструкцию протеза (например, накладной протез на балочной опоре). Кроме того, следует подчеркнуть, что контролировать осложнения и дискомфорт, связанные с изменением облученных слизистых оболочек, можно только путем регулярных осмотров и тщательного соблюдения домашней гигиены; все это является необходимым условием для улучшения качества жизни обследуемых пациентов.
Корреспонденция
Д-р Фабрицио Карини
Отделение одонтостоматологической хирургии
Больница Сан Джерардо
Виа Перголези, 33 — 20052 Монца
f.carini@hsgerardo.com
библиография
1. Chiapasco M, Gatti C, Casentini P, Procopio C. Иллюстрированное руководство по челюстно-лицевой хирургии. Милан: изд. Массон, 2006.
2. Chiapasco M. Имплантаты для пациентов с дефектами челюстно-лицевой области и после облучения. Материалы III Европейского семинара по пародонтологии. Lang NL, Karring T, Lindhe J (eds). Quintessence Books 1999;557-607.
3. Kluth EV, Jain PR, Stuchell RN, Frich JC Jr. A study of factors contributing to the development of osteoradionecrosis of the jaws. J Prosthet Dent 1988 Feb;59(2):194-201.
4. Granström G. Osseointegration in irradiated cancer patients: an analysis with regard to implant failures. J Oral Maxillofac Surg 2005 May;63(5):579-85.
5. Esser E, Wagner W. Зубные имплантаты после радикальной операции по поводу рака полости рта и адъювантной радиотерапии. Int J Oral Maxillofac Implants 1997 Jul-Aug;12(4):552-7.
6. Keller EE, Tolman DE, Zuck SL, Eckert SE. Эндооссальные имплантаты нижней челюсти и аутогенная костная пластика в облученной ткани: 10-летнее ретроспективное исследование. Int J Oral Maxillofac Implants 1997 Nov-Dec;12(6):800-13.
7. Schliephake H, Neukam FW, Schmelzeisen R, Wichmann M. Long-term results of endosteal implants used for restoration of oral function after oncologic surgery. Int J Oral Maxillofac Surg 1999 Aug;28(4):260-5.
8. Tolman DE, Taylor PF. Исследование костно-анкерных черепно-лицевых протезов: облученные пациенты. Int J Oral Maxillofac Implants 1996 Sep-Oct;11(5):612-9.
9. Альбректссон Т. Многоцентровый отчет об остеоинтегрированных оральных имплантатах. Journal of Prosthetic Dentistry 1988; 60(1):75-84.
10. Franzén L, Rosenquist JB, Rosenquist KI, Gustafsson I. Реабилитация с помощью имплантатов пациентов со злокачественными новообразованиями полости рта, прошедших радиотерапию и хирургическое лечение без вспомогательного гипербарического кислорода. Int J Oral Maxillofac Implants 1995 Mar-Apr;10(2):183-7.
11. Eckert SE, Desjardins RP, Keller EE, Tolman DE. Эндооссальные имплантаты в облученном тканевом ложе. J Prosthet Dent 1996 Jul;76(1):45-9.
12. Granström G, Tjellström A. Влияние облучения на остеоинтеграцию до и после установки имплантата: отчет о трех случаях. Int J Oral Maxillofac Implants 1997 Jul-Aug;12(4):547-51.
14. Marinello CP, Berglundh T, Ericsson I, Klinge B, Glantz PO, Lindhe J. Resolution of ligature lesions in the dog. J of Clinical Periodontology 1995;22:475-480.
15. Visch LL, van Waas MA, Schmitz PI, Levendag PC.Клиническая оценка имплантатов у облученных пациентов с раком полости рта. J Dent Res 2002 Dec;81(12):856-9.
17. August M, Bast B, Jackson M, Perrot D. Использование фиксированного нижнечелюстного имплантата у пациентов с раком полости рта: ретроспективное исследование. J Oral Maxillofac Surg 1998 Mar; 56(3):297-301.
19. Granström G, Tjellström A, Brånemark PI. Osseointegrated implants in irradiated bone: a case-controlled study using adjunctive hyperbaric oxygen therapy . J Oral Maxillofac Surg 1999 May;57(5):493-9.
20. Roumanas ED, Freymiller EG, Chang TL, Aghaloo T, Beumer J 3rd. Протезы с опорой на имплантаты при дефектах лица: отчет о выживаемости имплантатов в Калифорнийском университете за период до 14 лет. Int J Prosthodont 2002 Jul-Aug;15(4):325-32.
21. Niimi A, Ueda M, Kaneda T. Maxillary obturator supported by osseointegrated implants placed in irradiated bone: report of cases. J Oral Maxillofac Surg 1993 Jul;51(7):804-9.
22. Niimi A, Ueda M, Keller EE, Worthington P. Experience with osseointegrated implants placed in irradiated tissues in Japan and the United States. Int J Oral Maxillofac Implants 1998 May-Jun;13 (3):407-11.
23. Watzinger F, Ewers R, Henninger A, Sudasch G, Babka A, Woelfl G. Endosteal implants in the irradiated lower jaw. J Craniomaxillofac Surg 1996 Aug;24(4):237-44.
24. Taylor TD, Worthington P. Оссеоинтегрированная имплантационная реабилитация ранее облученной нижней челюсти: результаты ограниченного испытания через 3-7 лет. J Prosthet Dent 1993 Jan;69(1):60-9. Обзор.
